资讯中心
作者:梅颖怡
发布时间:2025-07-22
阅读:1044
肿瘤产生与发展涉及癌细胞与肿瘤微环境(TME)之间复杂且持续的相互作用。靶向TME的癌症免疫疗法已在临床试验中得到越来越多的验证,但不同肿瘤组织学类型间的治疗响应率存在显著差异,且疗效常呈现短暂性、个体特异性以及受耐药性干扰。能够再现肿瘤生物学特征与免疫治疗效果的患者特异性肿瘤免疫微环境实验模型,将极大促进免疫肿瘤治疗药物的患者筛选、靶点鉴定及耐药机制阐释。
当代肿瘤生物学认为肿瘤微环境是多因素协同作用的复杂系统,其中免疫系统呈现"热肿瘤"(免疫激活易治)与"冷肿瘤"(免疫抑制难治)两极分化特征,针对微环境重建的免疫疗法(如免疫检查点阻断、过继性细胞治疗等)正成为研究重点。随着对TME认知的深化与三维类器官技术的双重突破,现已具备提升体外癌症模型细胞复杂度(尤其是免疫组分)的技术条件。
肿瘤免疫类器官系统
类器官是干细胞衍生的三维培养体系,能再现器官结构与功能,可从多种肿瘤及正常组织高效构建,突破传统静态样本局限,完整保留肿瘤异质性与患者间差异。患者来源的肿瘤类器官(PDOs)支持动态研究,较二维细胞系和PDX模型更具优势。由于可从正常及病变组织快速制备,且美国典型培养物保藏中心(ATCC)主办的人类癌症模型计划(Human Cancer Models Initiative)等平台提供现成资源,此类浸没式类器官已获得广泛应用。尽管这类肿瘤类器官已推动多项重要发现,但传统肿瘤类器官仅含恶性细胞,其缺乏基质成分(尤其是免疫细胞)的特性,可能影响基于免疫治疗或非免疫治疗研究的准确性。构建整合肿瘤与TME组分的新型类器官系统,可能满足全面模拟癌症生物学特征及治疗响应机制的需求。
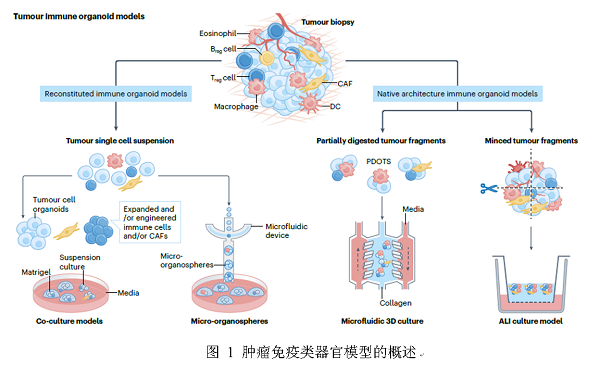
重构型基质与免疫类器官模型
这是一类通过肿瘤单细胞悬浮技术实现的培养模型。根据是否纯化患者来源肿瘤单细胞悬液可以分为两个细分的模型:
通过纯化+外源性补充的方式,分别重构上皮细胞、基质细胞及免疫细胞组分等元素,再根据研究需求特定地加入这些元素与迷你肿瘤进行共培养而构建的类器官模型,为阐明TME的各种组分的生物学功能提供了重要依据。这种方法现行涉及的大部分研究是针对TME当中有关T细胞的激活机制,也逐渐把关注点扩充到其他免疫群体。
采用非纯化的患者来源肿瘤单细胞悬液进行肿瘤细胞与匹配浸润基质/免疫细胞的短期共培养,该方法在肿瘤酶解消化后直接启动共培养体系,与先构建传统PDOs再添加免疫成分的重构模型存在本质差异。现有的技术有:微器官球体(MOS)培养,通过液滴乳化微流控技术,可从肿瘤活检单细胞悬液生成数千个MOSs,在活检样本获取后14天内完成抗PD1抗体及双特异性抗体的高通量药物敏感性评估(图1);或者是胶原/Matrigel三维培养体系,将黑色素瘤单细胞悬液在胶原或Matrigel基质中培养可维持免疫组分长达1个月,经IL-2与抗PD1联合处理的TILs可有效杀伤肿瘤细胞。
基于单细胞悬液的方法支持多重指标联合检测,具有更高通量筛选潜力(图1)。但值得注意的是,此类模型虽能保留天然免疫与基质细胞群,但破坏了组织原生空间排布,可能影响体外模型对关键免疫细胞互作、疾病进展及治疗响应的模拟准确性。
天然免疫类器官研究体系
为在原生细胞外基质(ECM)结构中完整保留TME的所有天然免疫与非免疫组分,学界已开发出更系统化的类器官研究方法。这类用于解析TME的创新体系主要包括气-液界面(ALI)类器官模型和患者来源的肿瘤类组织球体(PDOTS)(图1)。ALI培养体系通过将切碎的原代组织碎片嵌入胶原凝胶等ECM,置于transwell小室中培养。其上表面暴露于空气,底部培养液持续扩散营养,既保障氧气供应又维持原生架构与粘弹性特征,可生成保留内源性基质细胞与免疫细胞的天然免疫类器官。相较于浸没式培养,该技术无需重建即可保留肿瘤异质性、突变负荷及组织架构。肿瘤类组织球体(MDOTS)及患者来源的肿瘤类组织球体(PDOTS)体系通过微流控装置培养40-100微米肿瘤碎片,可在1-2周内模拟同源小鼠及患者TME。该模型保留自体淋巴细胞、髓系细胞及肿瘤细胞,可重现ICB响应及耐药现象,此外,无ECM血清游离培养中,0.5-1毫米胶质母细胞瘤碎片可形成悬浮球体类器官并维持免疫组分数周。
此类系统性模型存在一定局限:源自空间异质性显著肿瘤的类器官存在组内差异;多细胞类型共存及空间结构完整性需求的遗传工程改造复杂化;物理可及性限制可能需要开发原位细胞特异性递送技术。此外,体外观察到的免疫治疗响应需与患者预后进行前瞻性关联验证,这一环节在初期概念验证研究中尚未完善。总体说来,天然类器官技术主要是能保存原始肿瘤的基质与免疫组分,还可维持对肿瘤-TME互作至关重要的原生空间关系(图1),对靶向这类特征的免疫治疗有很大的临床转化潜力。
精准治疗的应用与后续的拓展

部分应用于精准治疗的研究结果(表1)展示了整合基质与免疫组分的肿瘤模型提升类器官的转化应用价值。为了进一步加强与体内实验的关联性,后续的研究模型可能引入次级淋巴器官类器官、微生物群或免疫肽组衍生细菌肽来提升模型复杂度。同时异种移植的活体成像技术也能动态地展示肿瘤内如浸润与逃逸一类的复杂互作过程。另外,新型的类器官模型构建思路也能应用到癌前发病机制的研究甚至扩展到其他免疫/感染性的疾病的发病与治疗研究当中。总体而言,类器官技术已深度融入当前癌症研究的革命性浪潮——其特征表现为肿瘤模型快速迭代与治疗手段持续革新。随着整合患者衍生免疫组分的类器官体系不断发展完善,其在TME全系统体外建模领域取得的进展,将推动日益丰富的免疫治疗药物真正转化为患者生存获益。
参考文献 1. Roel Polak 1,2, Elisa T. Zhang1 & Calvin J. Kuo1(2024) Cancer organoids 2.0: modelling the complexity of the tumour immune microenvironment. Nat Rev Cancer