资讯中心
作者:香雪生命科学
发布时间:2025-08-07
阅读:946
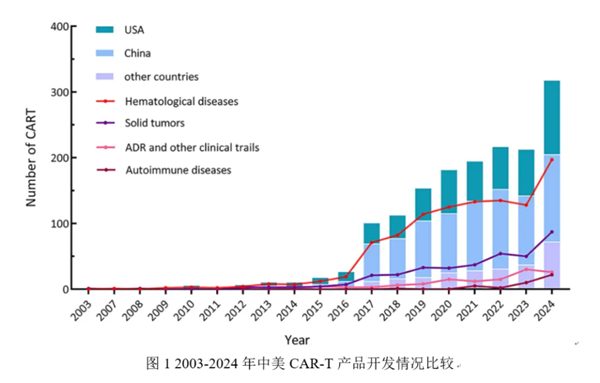
在过去的8年间,中国在T细胞过继免疫治疗行业的投入和临床试验数量上都有着井喷式的增长,这得益于政府的政策利好、充裕的资金投入以及庞大的受试者群体。以T细胞过继免疫治疗的主流产品之一CAR-T为例,数据显示,2024年中国启动的CAR-T临床试验数量已超越美国,成为全球CAR-T研发最活跃的地区(见图1)[4]。
然而,当绚烂的烟花散去,我们也必须直面一个现实,2024年,同样也是整个T细胞过继免疫治疗行业进入商业化深水区的一年。过去的一年,中国本土众多的细胞治疗产品开发公司迎来IND获批或产品上市的节点,这进一步加剧了行业竞争;同时,国家基本医保最高年支付线暂时无法覆盖主流的T细胞过继免疫治疗产品成本(如CAR-T和TCR-T,产品生产成本都在30-40万元左右),这进一步带来产品可及性的限制。
纵有千亿市场,破局仍需寻道
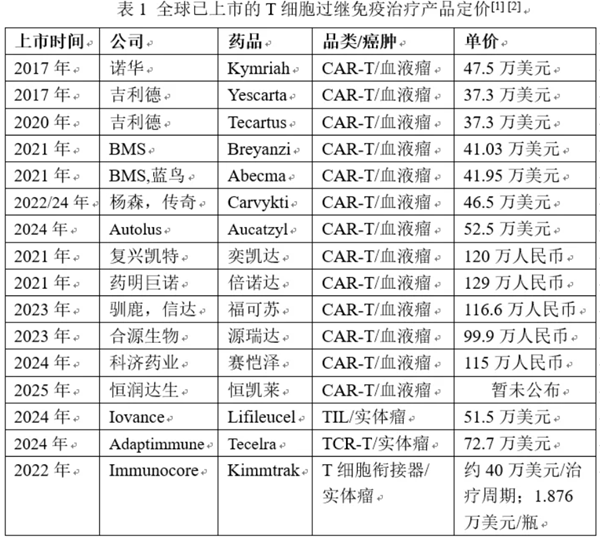
欧美上市的7款CAR-T产品定价都在40万美元左右,虽定价较高,但欧美人群支付力相对较强,所以每款产品年营销额都可达到数亿美元;国内上市的CAR-T产品相较欧美时间较短,但定价基本都在100万人民币左右,只有欧美产品定价的约40%,价格优势明显,但是国内CAR-T产品的销售额却普遍远逊于欧美,如吉利德公司2020年在美国上市的CAR-T产品Tecartus,2024年销售额为4.03亿美元(约28亿元人民币),而几乎同期在中国上市的药明巨诺CAR-T产品倍诺达,2024年销售额是1.58亿元人民币。我们不得不面对一个现实,中国拥有庞大的T细胞过继免疫治疗产品市场,但庞大的市场却并未带来可观的销售额,问题就出在产品的可及性上。
讲到这里,就不得不说一下中国的医疗体系和欧美的差别,为何T细胞过继免疫治疗产品在欧美的可及性要远超中国。以CAR-T产品为例,首先,中国的医疗体系结构决定了CAR-T治疗中心基本集中于少数大城市的三甲医院,这导致了显著的地域不均衡性,农村和末线城市的癌症患者触及CAR-T产品的难度更高,相比之下,美国拥有高度完善的医疗基础设施,CAR-T治疗已覆盖各地区的大医院和医学研究中心,并正在逐步向具备条件的社区癌症治疗中心扩展,这极大的拓宽了癌症患者获得CAR-T治疗的地域可及性。当然,中美CAR-T市场呈现出如此大的差距,更大程度上是因为两国宏观经济发展水平和医疗体系本质的差异,美国作为全球最大的经济体,2023年人均GDP超8万美元,其医疗卫生方面总支出占总GDP比重高达17.7% [5],庞大的医疗投入可很大程度上消化高成本的创新疗法,其以市场为主导、多层次支付的医疗体系,虽然也会被CAR-T产品的高价所困扰,但在为高价创新药寻找支付方层面更具灵活性和吸纳能力。而同期中国的人均GDP约为美国的六分之一,且医疗支出占总GDP的比重为7.2%[3][6],中国政府主导的医疗体系更侧重于基本医疗保障的公平性和广覆盖性,对于天价的T细胞过继免疫疗法,在尚未找到大规模可负担的解决方案前,仍采取谨慎的纳入策略,发展水平和制度理念的差异,从根本上制约了T细胞过继免疫治疗这类超高价值疗法在中国市场的渗透率。当然,中国也出台了一系列政策,推动T细胞过继免疫治疗产品进入商保/惠民保,努力增加这些天价创新药的可及性,但收效并不明显。
我们也应该清楚的意识到,政府在医保/商保层面上的努力,并不能从根本上改变天价创新药在中国的可及性问题,真正想让诸如CAR-T和TCR-T这种创新性强但价格超高的优质治疗惠及普通百姓,最根本的做法还是要从产品本身着手,降低成本,拉低定价,才是最好的出路。
优化性的成本降低
从目前主流的T细胞过继免疫治疗生产工艺着手,在各个环节进行降本优化,可在一定程度上拉低产品定价,提高产品可及性。下面的描述都以CAR-T为例,另一T细胞过继免疫治疗主流产品TCR-T也有类似考虑。
1、优化病毒载体生产:病毒载体是CAR-T疗法生产过程中技术壁垒最高、成本最高的一环,目前主流做法是通过元件质粒瞬时转染至宿主细胞,依托宿主细胞包装生产慢病毒载体,此项占据T细胞过继免疫治疗生产成本的20%-30%。降本策略都是针对如何提高病毒载体单次制备的产量、降低消耗和缩短周期等方面,一般有以下几种方式:可从基于贴壁细胞和细胞工厂的生产工艺升级到基于悬浮细胞和生物反应器的生产工艺;构建能稳定产毒的细胞系,使病毒生产不再依赖于元件质粒;设计与优化病毒载体分子,提高病毒原液滴度,降低病毒载体的细胞毒性。当然,也有一些研发公司另辟蹊径,探索非病毒转染技术,如基于转座子技术的非病毒基因转导体系,转座子系统发生基因整合具有一定的靶向性,且成本低,有潜力发展成为临床通用的T细胞基因转导系统;还有mRNA电穿孔技术,将CAR或TCR基因导入T细胞只需简单电击转化,但mRNA的不稳定性要求进行多次T细胞回输才能满足治疗效果。
2、实现自动化生产:利用全自动、封闭的免疫治疗细胞生产平台,如Miltenyi Biotec推出的CliniMACS Prodigy是一套全自动全体系的CAR-T生产平台,香雪生命科学与GE合作开发了全球第一条全自动TCR-T细胞制品生产线,这些都可显著降低劳动力和翻新成本,最大限度地降低微生物污染的风险,并提供生产一致性。
3、简化生产流程:如美国国立卫生研究院输血医学部细胞工程中心和美国国立癌症研究所儿科肿瘤科的研究人员设计了一种不需要白细胞分离术、低成本生产CAR-T细胞的方法,使用全血而非白细胞分离术获取细胞起始材料可降低制造复杂性和成本。
4、降低原材料成本:推动原材料国产化替代,降低进口依赖,如国产的培养基、试剂等,可有效降低生产成本。同时,对原材料进行严格的质量控制和成本管理,避免浪费和不必要的损耗。
5、外包非核心业务:对于一些非核心的业务环节,如临床研究、市场销售等,可以外包给专业的外包服务公司,这样可以降低企业的运营成本,同时提高业务的专业性和效率。
6、提高生产规模:随着CAR-T产品的市场需求增加,企业可以扩大生产规模,通过规模经济来降低单位产品的成本。例如,增加生产设备的利用率,提高生产效率,降低单位产品的固定成本和可变成本。
革命性的成本降低
上面所描述的,可定义为“优化性降本”但这种方式降本程度有限,试想在现实的中国社会,一个药品的定价为100万,老百姓用不起,即便是把定价拉低至60万,事实上老百姓还是用不起。想把昂贵的T细胞过继免疫治疗产品惠及所有普通中国百姓,其价格必须降低一个数量级,这种情况下“优化性降本”并不能解决问题,“革命性降本”才是最终的出路。目前在T细胞过继免疫治疗领域,通用型CAR-T/TCR-T和In vivo CAR-T/TCR-T是大家公认“革命性降本”的有效方式。下面的描述都以CAR-T为例,另一T细胞过继免疫治疗主流产品TCR-T也有类似考虑。
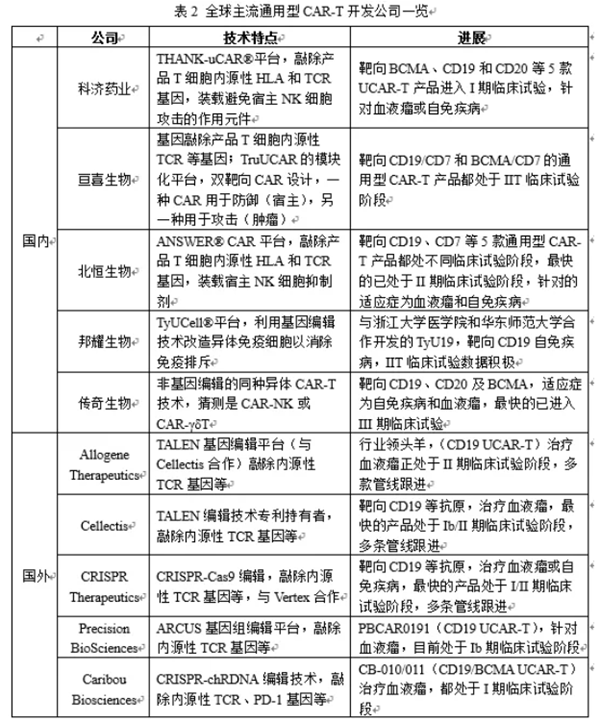
开发通用型CAR-T/TCR-T:通用型CAR-T又称同种异体CAR-T,是从健康供者体内采集T细胞,并在体外通过基因工程技术改造,敲除其内源性的HLA、TCR等会引起排异反应的因素,然后导入目标CAR分子并大规模扩增,制备成现货型的T细胞过继免疫治疗产品。由于其来源于健康供者,不受患者T细胞数量和质量影响,制备成功率高,单批次可满足上百人份的需求,可将生产成本降低约90%。因此近几年,通用型CAR-T在细胞治疗领域掀起了研发热潮(见表2)。当然,通用型CAR-T的开发依然面临诸多挑战需要克服。
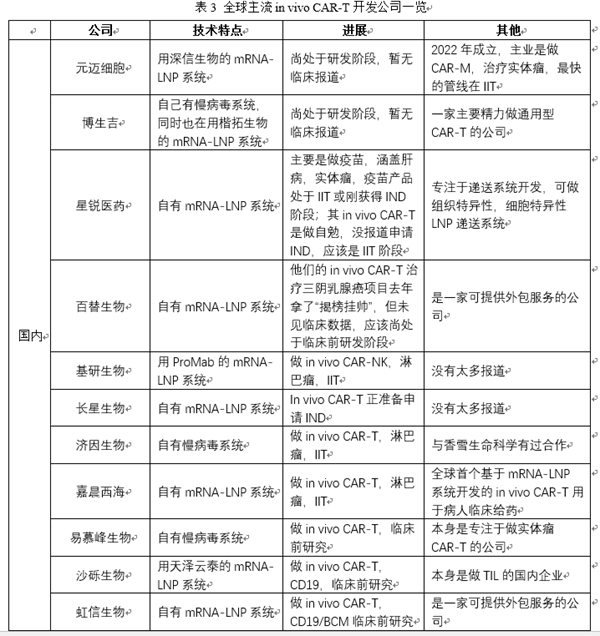
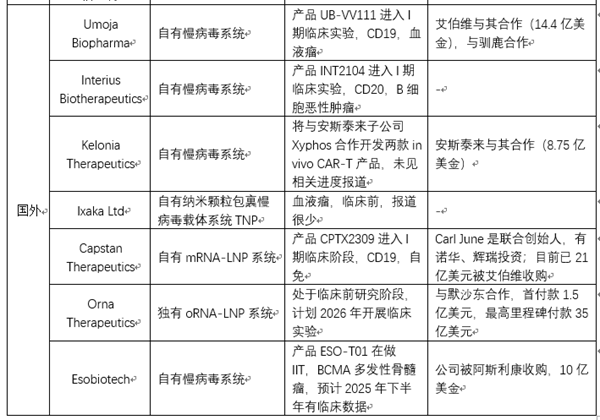
In vivo CAR-T/TCR-T 技术突破:In vivo CAR-T的思路是通过递送系统(如病毒载体或LNP等),将CAR基因或者CAR的mRNA递送到患者体内T细胞上,在患者体内实现CAR分子的表达,将患者体内的T细胞武装成为CAR-T,进而攻击肿瘤细胞,达到治疗效果。In vivo CAR-T通过直接在患者体内递送CAR分子,跳过体外制备环节,生产成本可降至传统CAR-T的10%,极大的提升可及性;同时,传统CAR-T制备需2-3周,患者可能因疾病进展错过最佳治疗时机,In vivo CAR-T无需体外培养,可实现“即用型”治疗,从诊断到治疗的时间大幅缩短,尤其适用于病情进展迅速的患者。基于In vivo CAR-T的这些颠覆性优势,全球各大MNC都在纷纷布局,力求争夺市场先机(见表3)。当然,In vivo CAR-T目前在血液瘤的治疗中取得不错的成果,但如同传统CAR-T一样,其在实体瘤中仍未有令人振奋的突破。鉴于体外TCR-T疗法在实体瘤中已有明确显著的疗效,In vivo TCR-T或许会是未来实体瘤治疗的另一主流发展方向。
“降本增效,应对市场”,这八个字是T细胞过继免疫治疗领域永远绕不开的话题,不管是CAR-T还是TCR-T,大家都在为这八个字不断的探索和奋斗!
参考/源引资料: [1] Alex Philippidis. Top 10 Best-Selling Cell and Gene Therapies: Ranking cell and gene therapies in terms of revenues shows a fairly stark line between feast and famine. Genetic Engineering & Biotechnology News. 2024; 44 (5) : 16-17. [2] 智研咨询.《2024-2030年中国CAR-T免疫细胞治疗行业市场深度监测及战略咨询研究报告》. 2024; www.chyxx.com/. [3] 2024年全国GDP数据出炉!人均为1.35万美元,总人口14.08亿-腾讯网https://news.qq.com/rain/a/20250117A0849W00. [4] Cao LY, et al. CAR-T cell therapy clinical trials: global progress, challenges, and future directions from ClinicalTrials.gov insights. Front Immunol. 2025 May 20;16:1583116. [5] WorldBnak-United states GDP. [6] 2023年我国卫生健康事业发展统计公报,卫健委、光大证券研究所.